03 | Förderprojekt
TAMEP und ihre Vorläuferzellen kontrollieren zentrale pathologische Merkmale des Glioblastoms

Förderperiode: 01.01.2026 – 31.12.2027
Projektleiter: Prof. Dr. Rainer Glaß
Neurochirurgische Universitätsklinik München
Projektbeschreibung
Dank der Förderung durch die Anni Hofmann Stiftung konnten wir in den letzten Jahren wichtige Einblicke in die Funktion von TAMEP und deren Vorläuferzellen bei der Expansion von Glioblastomen (GBM) gewinnen. Insbesondere konnten wir zeigen, dass TAMEP und TAMEP-Vorläufer einen doppelten pathologischen Einfluss auf den Tumorprogress haben: Erstens steuern TAMEP-Vorläuferzellen den Reifungsprozess der extrazellulären Matrix (Matrisom), die für eine Blutgefäßaussprossung und die Ausbildung der sogenannten Blut-Tumor-Schranke essenziell ist. Zweitens sekretieren differenzierte TAMEP chemoattraktive Faktoren, die zur Akkumulation myeloischer Zellen im Tumorherd führen und so eine inflammatorisches Milieu im GBM induzieren.
Die TAMEP-Vorläuferzellen fördern die Gefäßbildung und Gefäßdichtigkeit des GBM, indem sie das extrazelluläre Matrisom vernetzen und somit die Festigkeit der GBM Zellmasse und der GBM Vaskulatur erhöhen. Dies führt zu erhöhter Vaskularisierung und einer funktionellen Gefäßreifung (Blut-Tumor Schrankenbildung). Auf der Grundlage dieser Entdeckung beginnen wir nun, translationale Verfahren zur Eindämmung der Angiogenese und der Blut-Tumor Schrankenbildung in präklinischen Modellen zu testen. Im aktuellen Förderzeitraum zielen wir darauf ab, mittels einer kombinierten Blockade von Matrisom-vernetzenden Enzymen die pathologische Gefäßbildung und Reifung so zu modulieren, dass ein verbesserter Einstrom von Tumortherapeutika ins GBM möglich wird. Derzeit bildet die Blut-Tumor Schranke eine wesentliche Barriere bei der intratumoralen Aufnahme vieler Arzneimittel.
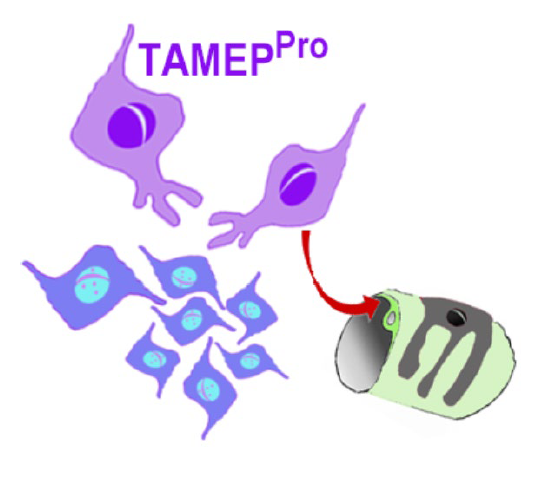
Interaktion von TAMEP Progenitorzellen (TAMEP PRO) mit GBM Zellen (in blau dargestellt) und Blutgefäßen. In frühen Stadien der Gliomagenese können parenchymale Vorläuferzellen die maligne Progression des Tumorprimordiums fördern. In späteren Stadien des GBM-Wachstums und bei rezidivierenden Tumoren steuern TAMEPPRO die Tumorgefäßbildung und die Bildung der Blut-Tumor-Schranke (BTB); hier versinnbildlicht mittels eines Pfeils. Die BTB vermindert das Eindringen von Chemotherapeutika in den Tumorraum.
Darüber hinaus werden wir die TAMEP-induzierte Inflammation und Fibrose des Gehirntumors untersuchen, da diese inflammatorischen Komponenten zur Invasion und Therapieresistenz von GBM beitragen. Derzeit ist noch nicht klar, wie TAMEP diese wichtigen pathologischen Signalwege steuern. Wir haben aber beobachtet das TAMEP Botenstoffe freisetzen, die inflammatorische, myeloische Zellen anlocken. Detaillierte Kenntnisse über die Signaltransduktionswege, die diesen Entzündungszyklus steuern, ermöglichen uns die Erarbeitung von Strategien für therapeutische Interventionen, die etablierte Behandlungsmethoden unterstützen.
