02 | Förderprojekt
The role of NKT cells in the endogenous anti-glioblastoma immune response initiated by CAR-NK cell therapy

Förderperiode: 01.01.2026 – 31.12.2027
Projektleitung: Dr. Michael Burger
Johann Wolfgang Goethe-Universität, Frankfurt am Main
Projektbeschreibung
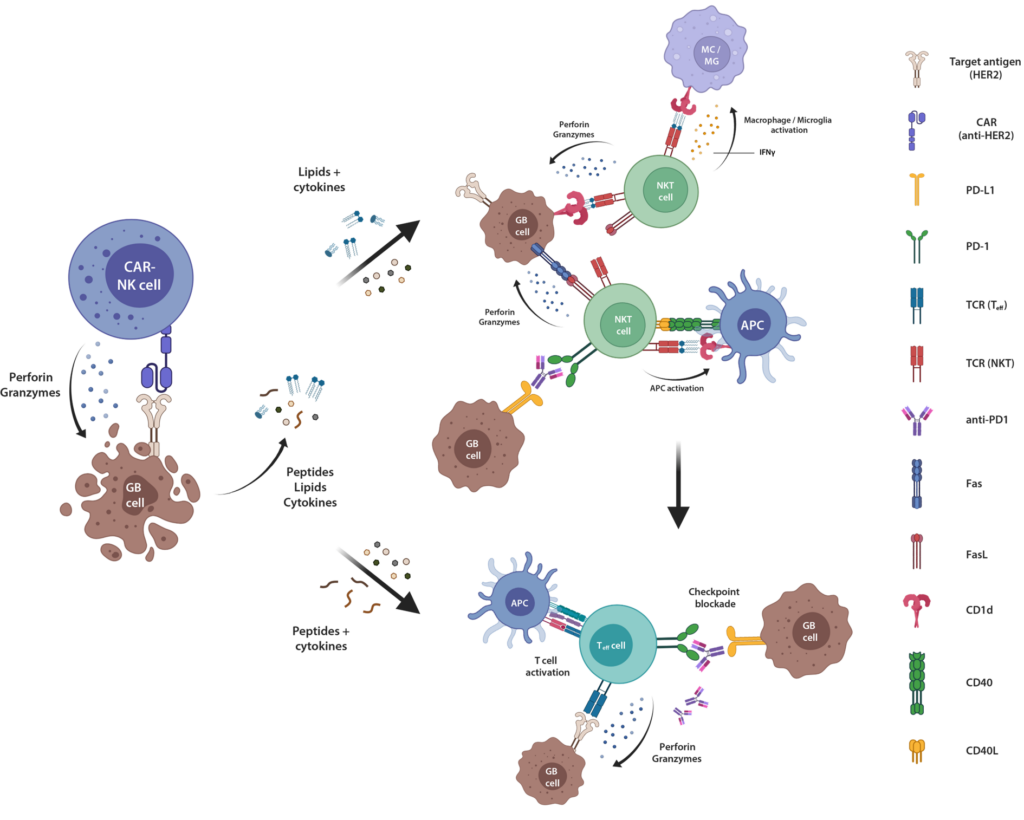
Glioblastomzellen hemmen die Aktivität des Immunsystems gegenüber dem Tumor durch Produktion von immunsuppressiven Molekülen wie dem PD-1-Liganden. In der letzten Förderperiode konnten wir bereits in Laborversuchen nachweisen, dass dieser für die Therapie sehr problematische Mechanismus durch Infektion von Tumorzellen mit einem von menschlichen Adeno-assoziierten Viren abgeleiteten Virussystem (HER2-AAV) durchbrochen werden kann. Nach Infektion des Tumors mit den HER2-AAVs werden dort Antikörperfragmente (ein sogenannter Checkpoint-Inhibitor) produziert, welcher die Immunantwort entblockiert. Dies wiederum konnte die Wirksamkeit von gegen die Glioblastomzellen gerichteten Natürlichen Killerzellen (CAR-NK-Zellen) deutlich steigern, da so die durch die CAR-NK-Zelltherapie angestoßene endogene Immunantwort gegen die Glioblastomzellen verbessert wurde, die entscheidend für eine dauerhafte Tumorkontrolle ist.
In Laborversuchen ergaben sich dabei Hinweise darauf, dass die Kombinationstherapie aus Checkpoint-Inhibition und CAR-NK-Zellen zu einem Anstieg einer spezifischen Population von Immunzellen, den Natürlichen Killer-T-Zellen (NKT-Zellen), führt. NKT-Zellen sind im Immunsystem für die Abwehr von Lipid-haltigen Tumorbestandteilen zuständig. Auch im Tumorgewebe von Patienten, welche im Rahmen der CAR2BRAIN-Studie mit der Kombinationstherapie aus CAR-NK-Zellen und einem Checkpoint-Inhibitor behandelt wurden, fanden wir eine Zunahme der NKT-Zellen.
In der aktuellen Förderperiode untersuchen wir daher die Bedeutung der NKT-Zellen für die durch eine Kombinationstherapie aus CAR-NK-Zellen und Checkpoint-Inhibitor ausgelöste endogene Immunantwort gegen den Tumor. Dabei sollen zunächst die zur Aktivierung der NKT-Zellen führenden Mechanismen detailliert charakterisiert und dann Strategien entwickelt werden, um die gewünschte anti-Tumoraktivität dieser Zellen zu steigern (Abb. 1). Die Bedeutung der so im Labor gewonnenen Erkenntnisse für die Patienten wird zudem durch begleitende Untersuchungen an Tumormaterial von Studienpatienten aus der CAR2BRAIN-Studie bestimmt.
Übergeordnetes Ziel des Forschungsprojekts ist dabei, durch rationale Kombination von zelIulären Immuntherapien und Immunmodulatoren die Effektivität dieser Therapien gegen Glioblastome zu verbessen.
Die Förderung dieses Projektes durch die Anni Hofmann Stiftung ist daher ein wichtiger Beitrag zur Entwicklung innovativer neuer Ansätze für Immuntherapien gegen Glioblastome.